醫療器械製造商印上圖示及標示的責任
2021年7月6日,ISO 15223-1:2021發布並取代了ISO 15223-1:2016,依據法規EN ISO 15223-1:2021(Medical devices — Symbols to be used with information to be supplied by themanufacturer — Part 1: General requirements)針對製造商在醫療器械中需要提供相關信息的標示之規定,而這些標示可在醫療器械本身、包裝或是仿單(Instruction For Use, IFU)中。
2021年版本與2016年版本的比較如下:
1.新增20個,這些標示已在15223-2中提出。
2.新增5個先前已發布在ISO 7000,ISO 7001和IEC 14971的新標示。
3.刪除”labelling”名詞解釋。
4.新增ISO 20417、ISO 13485及ISO 14971的一些術語。
5.增加附錄A的範例。
6.將有關歐洲法規的信息移至信息說明。
變更內容之標示:
|
標示項目 |
變更內容 |
|
|
1.刪除製造商定義解釋 |
|
|
新增:如多項標示(授權代表、進口商、經銷商、翻譯或 |
|
|
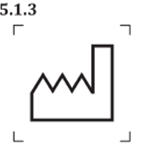
補充說明:此符號不得使用為帶有製造日期的5.1.11, |
|
|
補充說明: |
|
|
更新標題及描述: |
|
|
更新標題: 增加查閱電子說明書 |
|
|
更新描述:操作該器械或其控制裝置時必須注意,或當前 |
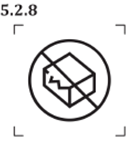
新增標示:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
計劃將您的產品投放到歐盟市場嗎?想了解更多有關您的產品或試驗是否符合送審法規的資訊嗎?
歡迎聯繫紳詠,我們會在產品投入市場的前後過程中為您提供支持!
參考資料:國際標準化組織https://www.iso.org/standards.html